

A forza de encollemento de calquera lonxitude da unidade na superficie do líquido chámase tensión superficial e a unidade é N. · M-1.

A propiedade de reducir a tensión superficial do disolvente chámase actividade superficial e unha sustancia con esta propiedade chámase sustancia activa na superficie.
A sustancia activa en superficie que pode unir moléculas en solución acuosa e formar micelas e outras asociacións, e ter unha alta actividade superficial, á vez que ten o efecto de humectar, emulsionar, escumar, lavar, etc. chámase tensioactivo.
O tensioactivo son compostos orgánicos con estrutura e propiedade especial, que poden cambiar significativamente a tensión interfacial entre dúas fases ou a tensión superficial de líquidos (xeralmente auga), con humectacións, espumantes, emulsionantes, lavado e outras propiedades.
En termos de estrutura, os tensioactivos teñen unha característica común porque conteñen dous grupos de natureza diferente nas súas moléculas. Nun extremo hai unha longa cadea de grupo non polar, soluble en aceite e insoluble en auga, tamén coñecida como grupo hidrofóbico ou grupo repelente de auga. Este grupo repelente en auga é xeralmente longas cadeas de hidrocarburos, ás veces tamén para fluoro orgánico, silicio, organofosfato, cadea de organotina, etc. No outro extremo está o grupo soluble en auga, un grupo hidrofílico ou un grupo repelente de aceite. O grupo hidrofílico debe ser suficientemente hidrofílico para asegurar que os tensioactivos enteiros sexan solubles na auga e teña a solubilidade necesaria. Dado que os tensioactivos conteñen grupos hidrofílicos e hidrofóbicos, poden ser solubles en polo menos unha das fases líquidas. Esta propiedade hidrofílica e lipófila do tensioactivo chámase anfifilicidade.


O tensioactivo é unha especie de moléculas anfifílicas con grupos hidrofóbicos e hidrofílicos. Os grupos hidrofóbicos de tensioactivos están xeralmente compostos por hidrocarburos de cadea longa, como o alquilo de cadea recta C8 ~ C20, alquilo de cadea ramificada C8 ~ C20 , alquilfenilo (o número de alquilo de carbono é 8 ~ 16) e similares. A diferenza que é pequena entre grupos hidrofóbicos está principalmente nos cambios estruturais das cadeas de hidrocarburos. E os tipos de grupos hidrofílicos son máis, polo que as propiedades dos tensioactivos están relacionadas principalmente con grupos hidrofílicos ademais do tamaño e forma de grupos hidrofóbicos. Os cambios estruturais dos grupos hidrofílicos son maiores que os dos grupos hidrofóbicos, polo que a clasificación de tensioactivos baséase xeralmente na estrutura dos grupos hidrofílicos. Esta clasificación baséase en se o grupo hidrofílico é iónico ou non, e divídese en tipos de tensioactivos aniónicos, catiónicos, non iónicos, zwitteriónicos e outros tensioactivos.

① Adsorción de tensioactivos no Interfac
As moléculas tensioactivas son moléculas anfifílicas con grupos lipofílicos e hidrófilos. Cando o tensioactivo se disolve na auga, o seu grupo hidrofílico está atraído pola auga e disólvese na auga, mentres que o seu grupo lipófilo é repelido pola auga e deixa a auga, dando lugar á adsorción de moléculas tensioactivas (ou ións) nas dúas fases das dúas fases, o que reduce a tensión interfacial entre os dous fases. As máis moléculas tensioactivas (ou ións) son adsorbidas na interface, maior será a redución da tensión interfacial.
② Algunhas propiedades da membrana de adsorción
Presión superficial da membrana de adsorción: adsorción de tensioactivos na interface gas-líquido para formar unha membrana de adsorción, como colocar unha folla flotante extraíble sen fricción na interface, a folla flotante empurra a membrana adsorbente ao longo da superficie da solución e a membrana xera unha presión na folla flotante, que se chama presión superficial.
Viscosidade superficial: como a presión superficial, a viscosidade superficial é unha propiedade exhibida pola membrana molecular insoluble. Suspendido por un anel de platino de fío metálico fino, de xeito que o seu plano entra en contacto coa superficie da auga do tanque, xira o anel de platino, o anel de platino pola viscosidade do obstáculo da auga, a amplitude decaída gradualmente, segundo a cal se pode medir a viscosidade superficial. O método é: En primeiro lugar, o experimento realízase na superficie da auga pura para medir a decadencia de amplitude e, a continuación, mídese a decadencia despois da formación da membrana superficial e a viscosidade da membrana superficial deriva da diferenza entre ambos.
A viscosidade superficial está estreitamente relacionada coa solidez da membrana superficial e, dado que a membrana de adsorción ten presión superficial e viscosidade, debe ter elasticidade. Canto maior sexa a presión superficial e maior sexa a viscosidade da membrana adsorbida, maior será o seu módulo elástico. O módulo elástico da membrana de adsorción de superficie é importante no proceso de estabilización da burbulla.
③ Formación de micelas
As solucións diluídas de tensioactivos obedecen ás leis seguidas de solucións ideais. A cantidade de tensioactivo adsorbida na superficie da solución aumenta coa concentración da solución, e cando a concentración alcanza ou supera un certo valor, a cantidade de adsorción xa non aumenta e estes excesos moléculas de tensioactivo están na solución dun xeito azar ou dalgún xeito regular. Tanto a práctica como a teoría demostran que forman asociacións en solución e estas asociacións chámanse micelas.
Concentración de micelas críticas (CMC): A concentración mínima na que os tensioactivos forman micelas na solución chámase concentración crítica da micela.
④ Valores CMC de tensioactivos comúns.

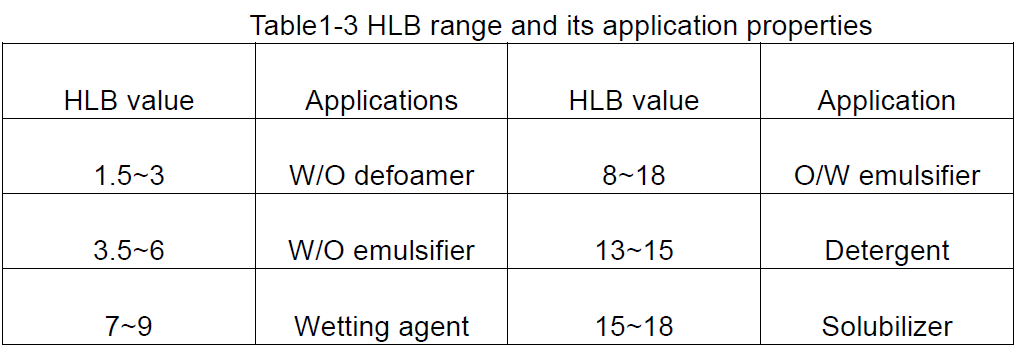
HLB é a abreviatura do equilibrio lipófilos hidrófilos, que indica o equilibrio hidrofílico e lipófilo dos grupos hidrofílicos e lipófilos do tensioactivo, é dicir, o valor HLB do tensioactivo. Un gran valor HLB indica unha molécula con forte hidrofilicidade e débil lipofilicidade; Pola contra, unha forte lipofilicidade e hidrofilicidade débil.
① Disposicións de valor HLB
O valor HLB é un valor relativo, polo que cando se desenvolve o valor HLB, como estándar, o valor HLB da cera de parafina, que non ten propiedades hidrofílicas, especifícase para ser 0, mentres que o valor HLB do dodecilo sulfato de sodio, que é máis soluble en 40. Os valores de HLB inferiores a 10 son lipófilos, mentres que os maiores de 10 son hidrófilos. Así, o punto de inflexión de lipofílico a hidrofílico é de aproximadamente 10.
A partir dos valores de HLB dos tensioactivos, pódese obter unha idea xeral dos seus posibles usos, como se mostra na táboa 1-3.

Dous líquidos mutuamente insolubles, un disperso no outro como partículas (pingas ou cristais líquidos) forman un sistema chamado emulsión. Este sistema é termodinamicamente inestable debido ao aumento da área límite dos dous líquidos cando se forma a emulsión. Para facer estable a emulsión, é necesario engadir un terceiro compoñente: emulsionante para reducir a enerxía interfacial do sistema. O emulsionante pertence ao tensioactivo, a súa función principal é xogar o papel da emulsión. A fase da emulsión que existe como pingas chámase fase dispersa (ou fase interior, fase discontinua), e a outra fase que se ligou entre si chámase medio de dispersión (ou fase exterior, fase continua).
① emulsionantes e emulsións
Emulsións comúns, unha fase é auga ou solución acuosa, a outra fase son as substancias orgánicas non miscibles con auga, como graxa, cera, etc. A emulsión formada pola auga e o petróleo pódese dividir en dous tipos segundo a súa dispersión: o petróleo dispersado en auga para formar petróleo en auga en auga, expresado como o/w (petróleo) (auga/aceite). Tamén se poden formar o tipo de auga-en-aceite en auga W/O/W e o aceite en auga en aceite O/W/O Multi-emulsións.
Os emulsionantes úsanse para estabilizar as emulsións reducindo a tensión interfacial e formando a membrana interfacial dunha soa molécula.
Na emulsificación dos requisitos do emulsionante:
R: O emulsionante debe ser capaz de adsorber ou enriquecer a interface entre as dúas fases, de xeito que se reduce a tensión interfacial;
B: O emulsionante debe dar as partículas á carga, de xeito que a repulsión electrostática entre as partículas ou forme unha membrana protectora altamente viscosa estable arredor das partículas.
Polo tanto, a sustancia empregada como emulsionante debe ter grupos anfifílicos para emulsificar e os tensioactivos poden cumprir este requisito.
② Métodos de preparación de emulsións e factores que afectan á estabilidade das emulsións
Hai dúas formas de preparar emulsións: un é usar o método mecánico para dispersar o líquido en pequenas partículas noutro líquido, que se usa principalmente na industria para preparar emulsións; O outro é disolver o líquido en estado molecular noutro líquido e, a continuación, facer que se reúna correctamente para formar emulsións.
A estabilidade dunha emulsión é a capacidade de agregación anti-partículas que leva á separación de fases. As emulsións son sistemas termodinamicamente inestables con gran enerxía libre. Polo tanto, a chamada estabilidade dunha emulsión é realmente o tempo necesario para que o sistema alcance o equilibrio, é dicir, o tempo necesario para a separación dun dos líquidos do sistema.
Cando a membrana interfacial con alcoholes graxos, ácidos graxos e aminas graxas e outras moléculas orgánicas polares, a forza da membrana significativamente maior. Isto débese a que, na capa de adsorción interfacial de moléculas emulsionantes e alcohois, ácidos e aminas e outras moléculas polares para formar un "complexo", de xeito que aumentou a forza da membrana interfacial.
Os emulsionantes que constan de máis de dous tensioactivos chámanse emulsionantes mixtos. Emulsionante mixto adsorbido na interface de auga/aceite; A acción intermolecular pode formar complexos. Debido á forte acción intermolecular, a tensión interfacial redúcese significativamente, a cantidade de emulsionante adsorbida na interface aumenta significativamente, aumenta a formación de densidade de membrana interfacial, aumenta a forza.
A carga das perlas líquidas ten un efecto significativo na estabilidade da emulsión. Emulsións estables, cuxas perlas líquidas son xeralmente cargadas. Cando se usa un emulsionante iónico, o ión emulsionante adsorbido na interface ten o seu grupo lipófilo inserido na fase de aceite e o grupo hidrofílico está en fase de auga, facendo que as perlas líquidas sexan cargadas. A medida que a emulsión ten a mesma carga, repélanse, non son fáciles de aglomerar, de xeito que aumenta a estabilidade. Pódese ver que canto máis emulsionantes ións adsorbidos nas perlas, maior sexa a carga, maior será a capacidade de evitar que as perlas se aglomeren, máis estable sexa o sistema de emulsión.
A viscosidade do medio de dispersión da emulsión ten unha certa influencia na estabilidade da emulsión. Xeralmente, canto maior sexa a viscosidade do medio de dispersión, maior será a estabilidade da emulsión. Isto débese a que a viscosidade do medio de dispersión é grande, o que ten un forte efecto sobre o movemento browniano das perlas líquidas e diminúe a colisión entre as perlas líquidas, de xeito que o sistema permaneza estable. Normalmente, as substancias de polímero que se poden disolver en emulsións poden aumentar a viscosidade do sistema e aumentar a estabilidade das emulsións. Ademais, os polímeros tamén poden formar unha forte membrana interfacial, facendo que o sistema de emulsión sexa máis estable.
Nalgúns casos, a adición de po sólido tamén pode facer que a emulsión tende a estabilizarse. O po sólido está na auga, o aceite ou a interface, dependendo do aceite, a auga da capacidade de humectación do po sólido, se o po sólido non está completamente mollado con auga, pero tamén mollado polo aceite, permanecerá na interface de auga e aceite.
O po sólido non fai que a emulsión sexa estable porque o po reunido na interface aumenta a membrana interfacial, que é similar á adsorción interfacial de moléculas emulsionantes, polo que canto máis estreita se dispón o material de po sólido na interface, máis estable é a emisión.
Os tensioactivos teñen a capacidade de aumentar significativamente a solubilidade de substancias orgánicas insolubles ou lixeiramente solubles en auga despois de formar micelas en solución acuosa, e a solución é transparente neste momento. Este efecto da micela chámase solubilización. O tensioactivo que pode producir solubilización chámase solubilizador, e a materia orgánica que se solubilizada chámase materia solubilizada.

A espuma xoga un papel importante no proceso de lavado. A escuma é un sistema de dispersión no que un gas está disperso nun líquido ou sólido, co gas como a fase dispersa e o líquido ou sólido como medio disperso, o primeiro chamado escuma líquida, mentres que o segundo chámase escuma sólida, como plástico espumado, vidro espumado, cemento espumado, etc.
(1) Formación de escuma
Por escuma queremos dicir aquí un agregado de burbullas de aire separadas por unha membrana líquida. Este tipo de burbullas sempre se levanta rapidamente ata a superficie do líquido debido á gran diferenza de densidade entre a fase dispersa (gas) e o medio de dispersión (líquido), combinado coa baixa viscosidade do líquido.
O proceso de formación dunha burbulla é levar unha gran cantidade de gas no líquido e as burbullas do líquido volven rapidamente á superficie, formando un agregado de burbullas separadas por unha pequena cantidade de gas líquido.
A escuma ten dúas características significativas en termos de morfoloxía: unha é que as burbullas como fase dispersada adoitan ter forma poliédrica, isto é porque na intersección das burbullas, hai unha tendencia para que a película líquida se delga para que as burbullas se convertan en poliedrais, cando a película líquida se atopa en certo xeito, lidera a burbulla; O segundo é que os líquidos puros non poden formar escuma estable, o líquido que pode formar escuma é polo menos dous ou máis compoñentes. As solucións acuosas de tensioactivos son típicas dos sistemas propensos á xeración de escuma, e a súa capacidade para xerar escuma tamén está relacionada con outras propiedades.
Os tensioactivos con bo poder de espuma chámanse axentes espumantes. Aínda que o axente espumante ten unha boa capacidade de escuma, pero a escuma formada pode non poder manter moito tempo, é dicir, a súa estabilidade non é necesariamente boa. Para manter a estabilidade da escuma, a miúdo no axente espumante para engadir substancias que poden aumentar a estabilidade da escuma, a sustancia chámase estabilizador de escuma, o estabilizador de uso común é a lauryl dietanolamina e o óxido de dodecil dimetilamina.
(2) estabilidade da escuma
A espuma é un sistema termodinamicamente inestable e a tendencia final é que a superficie total do líquido dentro do sistema diminúe despois de que a burbulla se rompa e a enerxía libre diminúe. O proceso de defoaming é o proceso polo que a membrana líquida que separa o gas faise máis grosa e máis fina ata que rompe. Polo tanto, o grao de estabilidade da escuma está determinado principalmente pola velocidade de descarga de líquidos e a forza da película líquida. Os seguintes factores tamén inflúen neste.
(3) Destrución da escuma
O principio básico da destrución da escuma é cambiar as condicións que producen a escuma ou eliminar os factores estabilizadores da escuma, polo que hai métodos físicos e químicos de defoaming.
A defoaming físico significa cambiar as condicións da produción de escuma mantendo a composición química da solución de escuma, como as perturbacións externas, os cambios na temperatura ou a presión e o tratamento por ultrasóns son métodos físicos eficaces para eliminar a espuma.
O método de defoaming químico é engadir certas substancias para interactuar co axente espumante para reducir a forza da película líquida na escuma e reducir así a estabilidade da escuma para lograr o propósito de defoaming, esas substancias chámanse defoamers. A maioría dos defoamers son tensioactivos. Polo tanto, segundo o mecanismo de defoaming, o defoamer debería ter unha forte capacidade para reducir a tensión superficial, fácil de adsorbir na superficie e a interacción entre as moléculas de adsorción de superficie é débil, as moléculas de adsorción dispostas nunha estrutura máis afrouxada.
Hai varios tipos de defoamer, pero basicamente, son tensioactivos non iónicos. Os tensioactivos non iónicos teñen propiedades anti-espumación preto ou por encima do punto da nube e adoitan usarse como defoamers. Os alcoholes, especialmente os alcoholes cunha estrutura de ramificación, ácidos graxos e ésteres de ácidos graxos, poliamidas, ésteres de fosfato, aceites de silicona, etc. tamén se usan como excelentes defoamers.
(4) escuma e lavado
Non hai vínculo directo entre a escuma e a eficacia do lavado e a cantidade de escuma non indica a eficacia do lavado. Por exemplo, os tensioactivos non iónicos teñen moito menos propiedades espumantes que os xabóns, pero a súa descontaminación é moito mellor que os xabóns.
Nalgúns casos, a escuma pode ser útil para eliminar a sucidade e a suciedade. Por exemplo, ao lavar os pratos na casa, a escuma do deterxente recolle as pingas de aceite e ao fregar alfombras, a escuma axuda a coller po, po e outra sucidade sólida. Ademais, a escuma ás veces pódese usar como indicación da eficacia dun deterxente. Debido a que os aceites graxos teñen un efecto inhibidor na escuma do deterxente, cando hai demasiado aceite e demasiado pouco deterxente, non se xerará escuma ou desaparecerá a escuma orixinal. Ás veces tamén se pode usar a escuma como indicador da limpeza dun aclarado, xa que a cantidade de escuma na solución de aclarado tende a diminuír coa redución do deterxente, polo que a cantidade de escuma pode usarse para avaliar o grao de aclarado.
En sentido amplo, o lavado é o proceso de eliminar compoñentes non desexados do obxecto para ser lavado e lograr algún propósito. O lavado no sentido habitual refírese ao proceso de eliminar a sucidade da superficie do portador. No lavado, a interacción entre a sucidade e o transportista está debilitada ou eliminada pola acción dalgunhas substancias químicas (por exemplo, deterxente, etc.), de xeito que a combinación de lixo e portador se converte na combinación de lixo e deterxente, e finalmente a sucidade está separada do portador. A medida que os obxectos a lavar e a sucidade a eliminar son diversas, o lavado é un proceso moi complexo e o proceso básico de lavado pódese expresar nas seguintes relacións sinxelas.
Carrie ·· Dirt + Deterxente = Carrier + Dirt · Deterxente
O proceso de lavado normalmente pódese dividir en dúas etapas: en primeiro lugar, baixo a acción do deterxente, a sucidade está separada do seu transportista; En segundo lugar, a suciedade separada está dispersa e suspendida no medio. O proceso de lavado é un proceso reversible e a suciedade dispersa e suspendida no medio tamén se pode volver a precipitar desde o medio ata o obxecto que se está lavando. Polo tanto, un bo deterxente debería ter a capacidade de dispersar e suspender a sucidade e evitar a redeposición de lixo, ademais da capacidade de eliminar a sucidade do transportista.
(1) Tipos de lixo
Incluso para o mesmo elemento, o tipo, a composición e a cantidade de lixo poden variar segundo o ambiente no que se usa. A sucidade do corpo de aceite é principalmente algúns aceites de animais e vexetais e aceites minerais (como aceite de cru, combustible, alcatrán de carbón, etc.), a sucidade sólida é principalmente hollín, cinza, ferruxe, negro de carbono, etc. En termos de lixo, hai lixo do corpo humano, como suor, sebum, sangue, etc.; sucidade de alimentos, como manchas de froita, manchas de aceite de cociña, manchas de condimento, almidón, etc.; suciedade de cosméticos, como batom, esmalte de uñas, etc.; suciedade da atmosfera, como hollín, po, barro, etc.; Outros, como tinta, té, revestimento, etc. Vén en varios tipos.
Os distintos tipos de sucidade normalmente pódense dividir en tres categorías principais: sucidade sólida, lixo líquido e sucidade especial.
① sucidade sólida
A sucidade sólida común inclúe partículas de cinza, barro, terra, ferruxe e negro de carbono. A maioría destas partículas teñen unha carga eléctrica na súa superficie, a maioría son cargadas negativamente e pódense adsorbir facilmente en elementos de fibra. A sucidade sólida é xeralmente difícil de disolver na auga, pero pode ser dispersada e suspendida por solucións de deterxente. A sucidade sólida cun punto de masa máis pequeno é máis difícil de eliminar.
② sucidade líquida
A sucidade líquida é principalmente soluble en aceite, incluíndo aceites vexetais e animais, ácidos graxos, alcoholes graxos, aceites minerais e os seus óxidos. Entre eles, poden producirse aceites vexetais e animais, ácidos graxos e saponificación alcalina, mentres que os alcoholes graxos, os aceites minerais non son saponificados por alcalos, pero poden ser solubles en alcohois, éteres e disolventes orgánicos de hidrocarburos e disulsificación de auga e disolución de auga deterxente. A sucidade líquida soluble en aceite xeralmente ten unha forza forte con elementos de fibra e é máis firmemente adsorbida en fibras.
③ sucidade especial
A sucidade especial inclúe proteínas, almidón, sangue, secrecións humanas como suor, sebo, ouriños e zume de froita e zume de té. A maior parte deste tipo de lixo pódese adsorbir químicamente e fortemente en elementos de fibra. Polo tanto, é difícil de lavar.
Os distintos tipos de lixo raramente se atopan soas, pero a miúdo mestúranse entre si e adsorben no obxecto. Ás veces, a sucidade pódese oxidarse, descompoñerse ou decaer baixo influencias externas, creando así nova sucidade.
(2) Adhesión de sucidade
A roupa, as mans, etc. pódese manchar porque hai algún tipo de interacción entre o obxecto e a sucidade. A sucidade adhírese a obxectos de varias formas, pero non hai máis que adhesións físicas e químicas.
① A adhesión de hollín, po, barro, area e carbón á roupa é unha adhesión física. En xeral, a través desta adhesión de lixo, e o papel entre o obxecto manchado é relativamente débil, a eliminación da sucidade tamén é relativamente fácil. Segundo as distintas forzas, a adhesión física da sucidade pódese dividir en adhesión mecánica e adhesión electrostática.
R: Adhesión mecánica
Este tipo de adhesión refírese principalmente á adhesión dalgunha sucidade sólida (por exemplo, po, barro e area). A adhesión mecánica é unha das formas máis débiles de adhesión de sucidade e pódese eliminar case por medios puramente mecánicos, pero cando a sucidade é pequena (<0.1um), é máis difícil eliminar.
B : Adhesión electrostática
A adhesión electrostática maniféstase principalmente na acción de partículas de lixo cargadas en obxectos cargados opostos. A maioría dos obxectos fibrosos son cargados negativamente na auga e pódense cumprir facilmente por certas sucias cargadas positivamente, como os tipos de cal. Algunha suciedade, aínda que cargada negativamente, como as partículas negras de carbono en solucións acuosas, poden adherirse ás fibras a través de pontes iónicas (ións entre múltiples obxectos cargados opositamente, actuando xunto con eles de forma como a ponte) formados por ións positivos na auga (por exemplo, Ca2+ , Mg2+ etc.).
A acción electrostática é máis forte que unha simple acción mecánica, dificultando a eliminación de sucidade.
② Adhesión química
A adhesión química refírese ao fenómeno da sucidade que actúa sobre un obxecto a través de enlaces químicos ou de hidróxeno. Por exemplo, a sucidade sólida polar, a proteína, a ferruxe e outra adhesión sobre elementos de fibra, as fibras conteñen carboxilo, hidroxilo, amida e outros grupos, estes grupos e ácidos graxos de lixo aceitosa, os alcoholes graxos son fáciles de formar enlaces de hidróxeno. As forzas químicas son xeralmente fortes e a sucidade está, polo tanto, máis firmemente unida ao obxecto. Este tipo de lixo é difícil de eliminar polos métodos habituais e require métodos especiais para tratalo.
O grao de adhesión da sucidade está relacionado coa natureza da sucidade en si e a natureza do obxecto ao que se adhire. Xeralmente, as partículas adhírense facilmente aos elementos fibrosos. Canto menor sexa a textura da sucidade sólida, máis forte é a adhesión. A sucidade polar en obxectos hidrofílicos como o algodón e o vidro adhírense con máis forza que a sucidade non polar. A sucidade non polar adhírese con máis forza que a sucidade polar, como as graxas polares, o po e a arxila, e é menos fácil de eliminar e limpar.
(3) Mecanismo de eliminación de sucidade
O propósito de lavar é eliminar a sucidade. Nun medio de certa temperatura (principalmente auga). Usando os diversos efectos físicos e químicos do deterxente para debilitar ou eliminar o efecto da sucidade e os obxectos lavados, baixo a acción de certas forzas mecánicas (como fregar as mans, axitación da lavadora, impacto da auga), de xeito que a sucidade e os obxectos lavados do propósito da descontaminación.
① Mecanismo de eliminación de lixo líquido
A : Moldando
O suelo líquido está principalmente baseado en aceite. As manchas de aceite mollan a maioría dos elementos fibrosos e esténdense máis ou menos como unha película de aceite na superficie do material fibroso. O primeiro paso na acción de lavado é a humectación da superficie polo líquido de lavado. Por mor da ilustración, pódese pensar a superficie dunha fibra como unha superficie sólida lisa.
B: desprendemento de aceite - mecanismo de curling
O segundo paso na acción de lavado é a eliminación do petróleo e a graxa, a eliminación da sucidade líquida conséguese por unha especie de bobina. A suciedade líquida existía orixinalmente na superficie en forma de película de aceite de propagación e baixo o efecto de humectación preferente do líquido de lavado na superficie sólida (é dicir, a superficie da fibra), enrolouse en perlas de aceite paso a paso, que foron substituídas polo líquido de lavado e finalmente deixaron a superficie baixo certas forzas externas.
② Mecanismo de eliminación de lixo sólido
A eliminación da sucidade líquida é principalmente a través da humectación preferente do portador de lixo mediante a solución de lavado, mentres que o mecanismo de eliminación para a sucidade sólida é diferente, onde o proceso de lavado trata sobre todo sobre a humectación da masa de terra e a súa superficie portadora mediante a solución de lavado. Debido á adsorción de tensioactivos na suciedade sólida e a súa superficie portadora, a interacción entre a sucidade e a superficie redúcese e a resistencia á adhesión da masa de terra na superficie redúcese, polo que a masa de terra elimínase facilmente da superficie do portador.
Ademais, a adsorción de tensioactivos, especialmente os tensioactivos iónicos, na superficie da sucidade sólida e o seu portador ten o potencial de aumentar o potencial superficial na superficie da sucidade sólida e do seu portador, que é máis propicio para a eliminación da suciedade. As superficies sólidas ou xeralmente fibrosas adoitan cargarse negativamente en medios acuosos e, polo tanto, poden formar capas electrónicas dobres difusas en masas de lixo ou superficies sólidas. Debido á repulsión de cargas homoxéneas, a adhesión de partículas de lixo na auga á superficie sólida está debilitada. Cando se engade un tensioactivo aniónico, porque pode aumentar simultaneamente o potencial superficial negativo da partícula de lixo e a superficie sólida, a repulsión entre eles é máis reforzada, a forza de adhesión da partícula é máis reducida e a sucidade é máis fácil de eliminar.
Os tensioactivos non iónicos son adsorbidos en superficies sólidas xeralmente cargadas e, aínda que non cambian significativamente o potencial interfacial, os tensioactivos non iónicos adsorbidos tenden a formar un certo grosor da capa adsorbida na superficie que axuda a previr a contido de sucidade.
No caso de tensioactivos catiónicos, a súa adsorción reduce ou elimina o potencial superficial negativo da masa de terra e a súa superficie portadora, o que reduce a repulsión entre a sucidade e a superficie e, polo tanto, non é propicio para a eliminación de lixo; Ademais, despois da adsorción na superficie sólida, os tensioactivos catiónicos tenden a converter a superficie sólida hidrofóbica e, polo tanto, non son propicios para o humectante da superficie e, polo tanto, lavarse.
③ Eliminación de solos especiais
Son difíciles de eliminar proteínas, almidón, secrecións humanas, zume de froita, zume de té e outras suciións deste tipo e requiren un tratamento especial.
As manchas de proteínas como a crema, os ovos, o sangue, o leite e os excrementos da pel tenden a coagularse nas fibras e dexeneración e obter unha adhesión máis forte. Pódese eliminar o suelo de proteínas mediante proteasas. A protease enzimática descompón as proteínas na terra en aminoácidos ou oligopéptidos solubles en auga.
As manchas de almidón proceden principalmente de alimentos, outros como a salsa, a cola, etc. A amilase ten un efecto catalítico na hidrólise das manchas de almidón, facendo que o almidón se descompoña en azucres.
A lipase cataliza a descomposición de triglicéridos, que son difíciles de eliminar mediante métodos normais, como o sebo e os aceites comestibles, e rompelos en glicerol soluble e ácidos graxos.
Algunhas manchas de cores de zumes de froitas, zumes de té, tintas, batom, etc. adoitan ser difíciles de limpar a fondo incluso despois do lavado repetido. Estas manchas pódense eliminar mediante unha reacción redox cun axente oxidante ou reductor como o lixivia, que destrúe a estrutura dos grupos xeradores de cor ou a cor-auxiliares e degradan en compoñentes máis pequenos solubles en auga.
(4) Mecanismo de eliminación de manchas de limpeza en seco
O anterior é realmente para a auga como medio de lavado. De feito, debido aos distintos tipos de roupa e estrutura, algunha roupa que usa lavado de auga non é conveniente ou non é fácil de lavar, algunha roupa despois do lavado e incluso deformación, esvaecemento, etc., por exemplo: a maioría das fibras naturais absorben auga e fáciles de hincharse e secas e fáciles de encoller, polo que despois do lavado deformarase; Ao lavar os produtos de la tamén aparecen a miúdo fenómeno de encollemento, algúns produtos de la con lavado de auga tamén son fáciles de pillar, cambio de cor; Algunhas sedas senten a man empeora despois de lavarse e perder o brillo. Para estas roupas adoita empregar o método de limpeza en seco para descontaminar. A chamada limpeza en seco refírese xeralmente ao método de lavado en disolventes orgánicos, especialmente en disolventes non polares.
A limpeza en seco é unha forma máis suave de lavado que o lavado de auga. Debido a que a limpeza en seco non require moita acción mecánica, non causa danos, engurras e deformación á roupa, mentres que os axentes de limpeza en seco, a diferenza da auga, raramente producen expansión e contracción. Sempre que a tecnoloxía se manexa correctamente, a roupa pódese limpar en seco sen distorsión, esvaecemento de cor e vida útil prolongada.
En termos de limpeza en seco, hai tres grandes tipos de lixo.
A suciedade soluble en aceite soluble en soluble en soluble inclúe todo tipo de aceite e graxa, que é líquida ou graxa e pódese disolver en disolventes de limpeza en seco.
② A suciedade soluble en auga soluble en auga soluble en solucións en solucións acuosas, pero non en axentes de limpeza en seco, é adsorbida na roupa en estado acuoso, a auga se evapora despois da precipitación de sólidos granulares, como sales inorgánicas, almidón, proteína, etc.
O aceite de lixo insoluble en auga e a auga insoluble de auga non é soluble en auga nin soluble en disolventes de limpeza en seco, como o negro de carbono, os silicatos de varios metais e os óxidos, etc.
Debido á diferente natureza de varios tipos de lixo, hai diferentes xeitos de eliminar a sucidade no proceso de limpeza en seco. Os solos solubles en aceite, como os aceites de animais e vexetais, os aceites minerais e as graxas, son facilmente solubles en disolventes orgánicos e pódense eliminar máis facilmente na limpeza en seco. A excelente solubilidade dos disolventes de limpeza en seco para aceites e graxas provén esencialmente das forzas de Van der Walls entre moléculas.
Para a eliminación de lixo soluble en auga como sales inorgánicas, azucres, proteínas e suor, a cantidade adecuada de auga tamén debe engadirse ao axente de limpeza en seco, se non, a sucidade soluble en auga é difícil de eliminar da roupa. Non obstante, a auga é difícil de disolver no axente de limpeza en seco, polo que para aumentar a cantidade de auga, tamén cómpre engadir tensioactivos. A presenza de auga no axente de limpeza en seco pode facer hidratada a superficie da suciedade e da roupa, de xeito que é fácil interactuar cos grupos polares de tensioactivos, o que é propicio para a adsorción de tensioactivos na superficie. Ademais, cando os tensioactivos forman micelas, a sucidade e a auga solubles en auga pódense solubilizar nas micelas. Ademais de aumentar o contido de auga do disolvente de limpeza en seco, os tensioactivos tamén poden desempeñar un papel na prevención da reposición da sucidade para mellorar o efecto de descontaminación.
A presenza dunha pequena cantidade de auga é necesaria para eliminar a sucidade soluble en auga, pero moita auga pode causar distorsión e engurras nalgunhas roupas, polo que a cantidade de auga no axente de limpeza en seco debe ser moderada.
A sucidade que non é soluble en auga nin as partículas sólidas solubles en aceite como a cinza, o barro, a terra e o negro de carbono, xeralmente están unidas á roupa por forzas electrostáticas ou en combinación con aceite. Na limpeza en seco, o fluxo de disolvente, o impacto pode facer que a adsorción de forza electrostática de suciedade e o axente de limpeza en seco poida disolver o aceite, de xeito que a combinación de aceite e sucidade e unida á roupa de partículas sólidas fóra do axente de limpeza en seco, a limpeza en seco, en pequena cantidade de auga e os seus prendentes, para que se produzan a disiudación de suxeición. roupa.
(5) Factores que afectan á acción de lavado
A adsorción direccional de tensioactivos na interface e a redución da tensión superficial (interfacial) son os principais factores na eliminación de suciedade líquida ou sólida. Non obstante, o proceso de lavado é complexo e o efecto de lavado, incluso co mesmo tipo de deterxente, está influenciado por moitos outros factores. Estes factores inclúen a concentración do deterxente, a temperatura, a natureza do suelo, o tipo de fibra e a estrutura do tecido.
① Concentración de tensioactivo
As micelas de tensioactivos en solución xogan un papel importante no proceso de lavado. Cando a concentración alcanza a concentración crítica de micela (CMC), o efecto de lavado aumenta drasticamente. Polo tanto, a concentración de deterxente no disolvente debe ser superior ao valor CMC para ter un bo efecto de lavado. Non obstante, cando a concentración de tensioactivo é superior ao valor CMC, o aumento incremental do efecto de lavado non é obvio e non é necesario aumentar demasiado a concentración de tensioactivo.
Ao eliminar o aceite por solubilización, o efecto de solubilización aumenta co aumento da concentración de tensioactivo, incluso cando a concentración está por encima do CMC. Neste momento, é recomendable usar deterxente dun xeito centralizado local. Por exemplo, se hai moita sucidade nos puños e colar dunha roupa, pódese aplicar unha capa de deterxente durante o lavado para aumentar o efecto solubilizador do tensioactivo no aceite.
②Temperature ten unha influencia moi importante na acción de descontaminación. En xeral, aumentar a temperatura facilita a eliminación da sucidade, pero ás veces unha temperatura demasiado alta tamén pode causar desvantaxes.
O aumento da temperatura facilita a difusión da sucidade, a graxa sólida emulsionase facilmente a temperaturas por encima do seu punto de fusión e as fibras aumentan o inchazo debido ao aumento da temperatura, que facilitan a eliminación da sucidade. Non obstante, para os tecidos compactos, os microgaps entre as fibras redúcense a medida que as fibras se expanden, o que prexudica a eliminación da sucidade.
Os cambios de temperatura tamén afectan a solubilidade, o valor CMC e o tamaño da micela dos tensioactivos, afectando así o efecto de lavado. A solubilidade dos tensioactivos con cadeas de carbono longo é baixa a baixas temperaturas e ás veces a solubilidade é incluso inferior ao valor CMC, polo que a temperatura de lavado debe ser elevada adecuadamente. O efecto da temperatura sobre o valor CMC e o tamaño da micela é diferente para tensioactivos iónicos e non iónicos. Para os tensioactivos iónicos, un aumento da temperatura xeralmente aumenta o valor CMC e reduce o tamaño da micela, o que significa que se debe aumentar a concentración de tensioactivo na solución de lavado. Para os tensioactivos non iónicos, un aumento da temperatura leva a unha diminución do valor CMC e a un aumento significativo do volume de micela, polo que está claro que un aumento adecuado da temperatura axudará ao tensioactivo non iónico a exercer o seu efecto activo na superficie. Non obstante, a temperatura non debe exceder o seu punto de nube.
En definitiva, a temperatura de lavado óptima depende da formulación de deterxente e do obxecto que se está a lavar. Algúns deterxentes teñen un bo efecto deterxente a temperatura ambiente, mentres que outros teñen unha deterxente moi diferente entre o lavado en frío e o quente.
③ escuma
É habitual confundir o poder espumante con efecto de lavado, crendo que os deterxentes con alto poder de espuma teñen un bo efecto de lavado. A investigación demostrou que non hai relación directa entre o efecto de lavado e a cantidade de escuma. Por exemplo, o lavado con deterxentes de escuma baixa non é menos eficaz que o lavado con deterxentes altos espumantes.
Aínda que a escuma non está directamente relacionada co lavado, hai ocasións en que axuda a eliminar a sucidade, por exemplo, ao lavar os pratos a man. Ao fregar alfombras, a escuma tamén pode quitar po e outras partículas sólidas de lixo, a alfombra contabiliza unha gran proporción de po, polo que os axentes de limpeza de alfombras deberían ter unha certa capacidade de espuma.
O poder de espuma tamén é importante para os xampus, onde a escuma fina producida polo líquido durante o xampú ou o baño deixa o pelo lubricado e cómodo.
④ variedades de fibras e propiedades físicas dos téxtiles
Ademais da estrutura química das fibras, que afecta á adhesión e eliminación da sucidade, a aparición das fibras e a organización do fío e do tecido inflúen na facilidade de eliminación de lixo.
As escalas de fibras de la e as cintas planas curvas de fibras de algodón son máis propensas a acumular lixo que as fibras lisas. Por exemplo, o negro de carbono manchado en películas de celulosa (películas de viscosa) é fácil de eliminar, mentres que o negro manchado en tecidos de algodón é difícil de lavar. Outro exemplo é que os tecidos de fibra curta feitos de poliéster son máis propensos a acumular manchas de aceite que os tecidos de fibra longa, e as manchas de aceite en tecidos de fibra curta tamén son máis difíciles de eliminar que as manchas de aceite nos tecidos de fibra longa.
Os fíos e tecidos axustados, debido á pequena brecha entre as fibras, poden resistir a invasión da sucidade, pero o mesmo tamén pode evitar que o líquido de lavado exclúa a sucidade interna, polo que os tecidos axustados comezan a resistir o ben, pero unha vez que o lavado tamén é máis difícil.
⑤ dureza da auga
A concentración de ións Ca2+, Mg2+ e outros ións metálicos na auga ten unha gran influencia no efecto de lavado, especialmente cando os tensioactivos aniónicos atopan ións Ca2+ e Mg2+ formando sales de calcio e magnesio menos solubles e reducirán a súa deterxencia. En auga dura, aínda que a concentración de tensioactivo é alta, a deterxente aínda é moito peor que na destilación. Para que o tensioactivo teña o mellor efecto de lavado, a concentración de ións Ca2+ na auga debe reducirse a 1 x 10-6 mol/L (Caco3 a 0,1 mg/L) ou menos. Isto require a adición de varios suavizantes ao deterxente.
Tempo de publicación: FEB-25-2022



